La tabla periódica es uno de los iconos más reconocibles de la ciencia. Algunos la consideran la piedra Rosetta de la naturaleza ya que permite organizar los componentes básicos de la materia, inferir sus propiedades y predecir sus interacciones.
Los antiguos filósofos griegos reconocían 4 principios básicos constituyentes de la materia: tierra, agua, aire y fuego, a los que correspondían las formas de los sólidos platónicos. Estos principios eran considerados conceptos abstractos, potencialidades o tendencias que originaban las propiedades de las sustancias. La idea de estos principios es consistente con los estados físicos en los que se presenta la materia. Así, la tierra representaba las rocas, el hierro, el oro, el agua todos los líquidos, el aire todos los gases y vapores…
La primera persona en descubrir la periodicidad química fue Émile de Chancourtois, que al ordenar los elementos según su peso atómico en forma de espiral en torno a un cilindro, observó que aquellos con propiedades químicas similares caían en la misma vertical. Chancourtois tuvo mala suerte ya que la primera publicación de 1862, que tuvo más impacto, no incluyó el diagrama de la representación lo cual es fundamental en el caso de un sistema periódico. Esta idea clave pasó desapercibida entre los químicos, primero porque fue enunciada por un geólogo y segundo porque era adelantada para su tiempo. Su aportación sería reconocida 30 años después de la publicación de su innovador artículo.
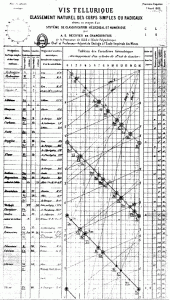
En 1863 John Newlands clasificó los elementos en 11 grupos cuyos componentes presentaban propiedades parecidas y se observó que los pesos atómicos diferían en 8 unidades o en múltiplos de 8. Un año más tarde propondría la ley de las octavas, según la cual al ordenar los elementos según el peso atómico el octavo tenía propiedades similares al primero. Esta idea no fue bien aceptada por la Royal Society of Chemistry, entre otras cosas se le criticaba que no podía colocar elementos recién descubiertos, que no utilizó los pesos de Cannizzaro y asigno números enteros a los pesos de los elementos y que algunos elementos no encajaban en la posición adjudicada.
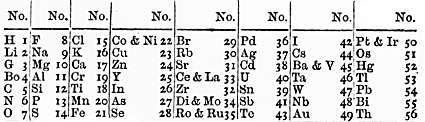
Si bien Mendeleev había estado trabajando en la clasificación de los elementos durante unos diez años, parece que tuvo su «momento eureka» el 17 de febrero de 1869. Esa tarde planteó un boceto de tabla en el que distribuyó los 63 elementos conocidos, dejó huecos y se atrevió a predecir las propiedades que presentarían los elementos que los ocuparían. Además, a pesar de considerar fundamental el criterio del peso atómico, no dudó en invertir el orden del telurio y del iodo, si bien atribuyó esta anomalía a un error en el cálculo de los pesos atómicos. Mendeleev envió 200 copias de esta tabla a químicos de toda Europa y el 6 de marzo de dicho año se anunció el descubrimiento en una reunión de la Sociedad Química Rusa.

El descubrimiento del argón y la dificultad de situarlo en la tabla, puso a prueba la ley de periodicidad. El tema fue resuelto en 1900 cuando Ramsey informó que este elemento junto con el helio, neón, kriptón y xenón que finalmente pudieron ser aislados, constituían un nuevo grupo que se situaría entre los halógenos y los alcalinos.
El estudio del átomo y los avances de la física del siglo XX nos han llevado a una nueva etapa en la interpretación y explicación de la tabla donde la física, según Eric Scerri, ha invadido la tabla periódica.












